Tecniche di induzione dell’ovulazione nelle Inseminazioni Intra-uterine
Benaglia Laura1,2, Vighi Valentina1,2, Santi Giulia1,2, Ragni Guido1
Introduzione
La specie umana è caratterizzata per natura da un basso indice di fertilità: una coppia normalmente fertile, con regolari rapporti, ha una probabilità del 25% di concepimento ogni mese. Solo l’80-90% delle coppie riesce a concepire dopo due anni di tentativi. Nelle rimanenti coppie, definite infertili, è necessario procedere a procedure diagnostiche o terapeutiche. Si definiscono tecniche di Procreazione Medico Assistita (PMA) le procedure che prevedono la manipolazione dei gameti,che possono essere di primo e secondo livello. Le tecniche di primo livello comprendono procedure in cui, pur aumentando le probabilità di concepimento in coppie infertili, la fecondazione avviene all’interno dell’apparato genitale femminile. Le tecniche di secondo livello comprendono le procedure in cui la fecondazione avviene in laboratorio. L’inseminazione intra-uterina (IUI) è la tecnica che maggiormente rispetta le normali tappe dei processi di riproduzione e consiste nell’introduzione nell’utero, mediante un sottile catetere, degli spermatozoi del partner preventivamente preparati,nel giorno dell’ovulazione. (Figura 1).
L’ovulazione, quindi, può essere spontanea oppure indotta da farmaci. Il razionale di questa seconda scelta terapeutica è che la stimolazione ovarica aumenta il numero di oociti disponibili, corregge eventuali problemi anovulatori femminili e aumenta ulteriormente le probabilità di concepimento. I farmaci a disposizione per la stimolazione ovarica sono differenti e sono stati ampiamente confrontati in termini di percentuali di gravidanze ottenute ed effetti collaterali.
I farmaci anti-estrogeni
I farmaci anti-estrogeni agiscono a livello ipofisario in modo competitivo sui recettori per gli estrogeni bloccandoli e inducendo una produzione endogena di FSH da parte dell’ipofisi stessa con un conseguente sviluppo ovarico mono o pluri follicolare. I farmaci anti-estrogeni, grazie alla loro efficacia e alla facile somministrazione perché per via orale, in rapporto ad un basso costo, trovano ampio utilizzo in donne giovani, oligo-anovulatorie con indicazione ad IUI. Il trattamento è effettuato con Clomifene citrato in dosi variabili tra 50 mg a 200 mg al giorno per 5 giorni (3° - 7° giorno del ciclo).
Diversi studi hanno comparato l’efficacia degli antiestrogeni rispetto a quella delle gonadotropine. Un’ampia revisione della letteratura disponibile ha evidenziato una maggior efficacia delle gonadotropine rispetto agli antiestrogeni in termini di percentuali di gravidanza (OR 1.8, 95%CI
Un recente studio retrospettivo sull’utilizzo di Clomifene citrato (CC) per le induzioni dell’ovulazione in caso di IUI ha mostrato percentuali medie di gravidanza per ciclo intorno al 5% (Custers et al., 2008) Pertanto, tale dato, associato al più basso costo del farmaco rispetto alle gonadotropine, è sufficiente a giustificare l’utilizzo del CC nelle coppie con indicazione ad IUI come primo approccio terapeutico.
Inoltre, per quanto riguarda il rischio di gemellarità, va sottolineato che non esistono evidenze in grado di confermare che le gonadotropine conducano ad un aumentato rischio di gravidanze multiple rispetto agli antiestrogeni. Infatti la Cochrane review del 2007 sopra citata riporta un rischio di gravidanza multipla per ciclo di IUI pressoché uguale con antiestrogeni e con gonadotropine (9.8% e 10% rispettivamente). (Cohlen et al., 2007)
Gonadotropine
Le gonadotropine esogene agiscono direttamente a livello ovarico determinando una selezione follicolare multipla e un’aumentata produzione di ovociti. Pertanto, l’utilizzo delle gonadotropine nei cicli di IUI si è imposto come trattamento di elezione di stimolazione ovarica controllata. Negli anni sono stati studiati i diversi piani terapeutici e sono stati paragonati tra loro in termini di efficacia. Sono stati confrontati: 1) l’uso dell’hMG rispetto al FSH; 2) l’impiego del FSH urinario (u-FSH) rispetto al FSH ricombinante (r-FSH); 3) l’utilizzo di regimi a basso (<75UI/die) ed alto dosaggio (>75UI/die).
Per quanto riguarda il primo punto, secondo gli autori di una revisione della letteratura per la Cochrane Library del 2007 , non ci sono evidenze che mostrano un aumento delle percentuali di gravidanze con l’impiego di hMG rispetto al FSH (OR 2.2, 95%CI: 0.91-5.1). Tuttavia va tenuto presente che gli studi disponibili analizzavano campioni poco numerosi e che i dosaggi di gonadotropine presentavano una significativa variabilità intercampione.
Esistono quattro studi che hanno paragonato l’impiego di u-FSH rsipetto al r-FSH per un totale di 444 coppie analizzate; non sono emerse differenze significative nelle percentuali di gravidanza tra i due tipi di stimolazione ovarica nè differenze significative nel numero di gravidanze multiple. (Gerli et al., 2004a, Gerli et al., 2004b, Matorras et al., 2000, Pares et al., 2002)
Tuttavia ci sono dei fattori confondenti nei lavori sopracitati che possono influenzare questa conclusione. Prima di tutto in entrambi gli studi di Gerli et al i dosaggi di gonadotropine erano differenti: 75 UI di u-FSH e 50 UI di r-FSH; si potrebbe pertanto ipotizzare che il tasso di gravidanze in seguito a stimolazione con r-FSH sia stato sottostimato. Ciò nonostante, negli altri due lavori le dosi dei due farmaci utilizzate erano le medesime senza comunque riportare una differenza significativa in numero di gravidanze ottenute.
Devono essere inoltre essere analizzati ulteriori aspetti per la comparazione di questi due farmaci. Infatti, da un lato, l’u-FSH presenta un costo dal 33% al 50% inferiore rispetto al r-FSH; dall’altro lato l’r-FSH garantisce una maggior purezza del farmaco, evitando potenziali reazioni allergiche e eventuali rischi infettivi. (Gerli et al., 2004a)
Infine, quattro studi hanno comparato diversi regimi terapeutici, confrontando bassi e alti dosaggi di gonadotropine. Due studi hanno confrontato 75 UI e 150 UI di gonadotropine giornaliere senza riscontrare differenze significative in termini di gravidanze. (Dahliwal et al., 2002, Sengoku et al., 1999). (Tabella 2) Un terzo studio del 1998 aveva comparato tre schemi differenti di induzione non mostrando anche in questo caso alcuna differenza significativa in termini di gravidanze ottenute (5.4% versus 0% e 0%, nei tre gruppi, rispettivamente). (Hughes et al., 1998) Infine l’ultimo di questi 4 lavori ha paragonato il trattamento con r-FSH 50 UI in somministrazione quotidiana associato a GnRH-antagonista rispetto al trattamento con r-FSH 50 UI a giorni alterni e GnRH-antagonista, mostrando una percentuale di gravidanze significativamente più elevata nel primo gruppo di pazienti rispetto al secondo (37% e 6%, rispettivamente). Ne consegue perciò, non solo che a dosi minime avviene comunque una risposta da parte dell’ovaio alla stimolazione, ma che vi è anche la necessità di utilizzare una dose minima giornaliera di gonadotropine in un ciclo di induzione per ottenere tale risposta. (Ragni et al., 2004).
Per concludere, diversi lavori hanno confrontato il rischio di gravidanza multipla associato a diversi regimi terapeutici. E’ emerso che l’utilizzo di alte dosi di gonadotropine induce un’aumentata probabilità di gravidanze plurime senza un effettivo incremento delle gravidanze totali ottenute. Ne consegue logicamente che una stimolazione ovarica con dosaggi di gonadotropine moderati dovrebbe ridurre i rischi di gemellarità. Un lavoro molto interessante a questo proposito fu uno studio prospettico su pazienti sottoposte a IUI del 2006, che prevedeva un protocollo con 50UI di FSH associato a GnRH antagonisti, in combinazione con criteri clinici ed ecografici di cancellazione del ciclo in caso di eccessiva risposta alla stimolazione. La conclusione fu che tale schema terapeutico permise di ottenere una percentuale di gravidanza del 9.2% (IC95%:7,5%-11,1%) con un rischio ridotto di gravidanza gemellare (9.5%;IC95%:5,3%-16,2%) e multipla (0%; IC95%:0,0%-3,2%) (Ragni et al., 2006) (Tabella 3)
L’associazione con GnRH antagonisti
In questi ultimi anni, l’ampio utilizzo delle gonadotropine nell’induzione dell’ovulazione associata a IUI ha portato a rivolgere l’attenzione alla efficacia di questi farmaci ma anche alla loro sicurezza con lo scopo di ottenere migliori protocolli terapeutici. A questo proposito si è molto discusso nel mondo scientifico l’utilizzo dei GnRH antagonisti nelle inseminazioni intra-uterine (IUI). I GnRH antagonisti agiscono legandosi in modo competitivo ai recettori ipotalamici inibendo quindi i meccanismi di feed-back ipofisari e il rilascio di GnRH endogeno e pertanto la secrezione di gonadotropine esogene. Questi farmaci quindi presentano il vantaggio di poter prevenire il picco prematuro di LH prima che i follicoli abbiano raggiunto dimensioni ottimali e l’endometrio lo spessore adeguato. Un picco prematuro di LH in un ciclo naturale è un evento raro, ma la frequenza di questo fenomeno, secondo dati in letteratura, aumenta sensibilmente al 25%-30% dei casi in cicli stimolati di IUI. In un recente ampio studio multicentrico sono state considerate 299 pazienti di cui 148 trattate con GnRH antagonista. Le percentuali di gravidanze ottenute nei due gruppi sono risultate essere rispettivamente del 12.2% e 12.7%.(p = 1.0) (Crosignani et al., 2007)
Nella revisione della letteratura della Cochrane Library del 2007 dalle conclusioni degli autori è emerso che i GnRH antagonisti giocano un ruolo nelle IUI con induzione dell’ovulazione nell’incremento delle probabilità di gravidanza ma che, tuttavia, sono necessari ulteriori studi su ampi numeri per confermarne la necessità di impiego. ( Cantineau et al. 2007)
Da una meta-analisi ancora più recente si evince come l’utilizzo dei GnRH antagonisti impedisca un prematuro picco di LH e in questo modo incrementi il numero di gravidanze ottenute. Risultò infatti una maggiore percentuale di gravidanza negli studi randomizzati controllati di questa meta-analisi con l’aggiunta di GnRH antagonista alla stimolazione ovarica (OR 1.56%, IC95%: 1.05-2.33) Parallelamente si è osservato un aumento anche del numero di gravidanze multiple,anche se tale dato non ha raggiunto una significatività statistica.(Kosmas et al., 2008)
Anche nell’analisi di tutti gli studi randomizzati controllati presenti in letteratura, la media delle percentuali di gravidanza ottenute da cicli di IUI con GnRH antagonista, è risultata aumentata del 5.3% (95%IC: 1.5-9.2). (The ESHRE Capri Workshop Group, 2009) (Tabella 4)
In conclusione, gli studi fino ad ora disponibili non sono concordi nell’assegnare un ruolo preciso dei GnRH antagonisti nei cicli di IUI in termini di miglioramento delle percentuali di gravidanza ottenute, tuttavia con il progredire degli studi e con l’ampliarsi della casistica c’è una tendenza a confermare che la loro introduzione sia efficace ai fini di incrementare le gravidanze ottenute.
Il progesterone è l’ormone assolutamente necessario per l’instaurarsi della gravidanza. Le concentrazioni minime affinché il progesterone sia efficace non sono ancora del tutto note. Tuttavia in letteratura non state riportate gravidanze ad esito positivo con concentrazioni di Progesterone inferiori a 15 nmol/L durante i primi 14 giorni di gestazione. La funzioni secretive svolte dal corpo luteo sono dipendenti dalla secrezione ipofisaria di LH che a sua volta dipende dal rilascio di GnRH ipotalamico. Ne consegue che nei cicli FIVET, in cui c’è una lunga soppressione di GnRH endogeno tramite farmaci GnRH-agonisti, i livelli di LH sono soppressi con una cessazione di produzione di Progesterone da parte del corpo luteo. Questo è il razionale per cui nei cicli FIVET si fornisce una supplementazione di Progesterone in fase luteale.
Dato che la stimolazione ovarica nei cicli di IUI determina uno sviluppo multifollicolare, questo può determinare un’alterazione nei meccanismi i feedback che normalmente regolano la crescita di un solo follicolo per ciclo. Di conseguenza, la fase luteale in questi cicli è caratterizzata da alti livelli di Estrogeni e Progesterone che, insieme ad alte concentrazioni di Inibina A, sopprimono i livelli circolanti di FSH e LH. Si può supporre quindi che bassi livelli di LH possano indurre il corpo luteo a sopprimere la propria produzione di Progesterone con conseguente deiscenza precoce del corpo luteo e “fase luteale breve”. Gli alti livelli di estrogeni, dall’altro lato, potrebbero giocare un ruolo non ancora del tutto noto nel determinare la brevità della fase luteale. La teoria attualmente più accreditata sostiene che alte concentrazioni di estrogeni determinano un’alterazione istologica dell’endometrio con compromissione dell’impianto embrionale, tuttavia quest’ultimo passaggio non è ancora stato dimostrato.
Risulta inoltre molto dibattuta la necessità di una supplementazione in fase luteale nei cicli di IUI. Anche se non è presente ad oggi una revisione sistematica della letteratura inerente la supplementazione della fase luteale nei cicli di IUI. In un lavoro recente Erdem et al hanno reclutato 214 pazienti randomizzandone 109 per il trattamento con progesterone vaginale e 105 come gruppo di controllo. Sono risultate 56 gravidanze ottenute nel gruppo di studio e 26.8 nel gruppo di controllo con percentuali di gravidanza rispettivamente nei due gruppi del 21.1% e 12.7%, con una differenza significativamente significativa. (Erdem et al.,2008)
Secondo il gruppo ESHRE Capri Workshop 2009, si può concludere che non esistono evidenze biologiche o cliniche robuste che giustifichino la supplementazione con progesterone nei cicli di IUI con stimolazione moderata (“mild stimulation”), cioè, con lo sviluppo di 2-3 follicoli per ciclo. Infatti le pazienti sottoposte a induzione dell’ovulazione nei cicli di IUI non hanno una tale soppressione ipogonadotropa, anche se trattate con antagonisti, da legittimare l’impiego di progesterone in fase luteale.
Inoltre l’hCG somministrato per l’induzione dell’ovulazione ha una emivita relativamente lunga, concentrazioni biologicamente significative persistono per almeno 10 giorni dalla somministrazione. (ESHRE Capri Workshop Group 2009)
Bibliografia
Cantineau AE, Cohlen BJ, Heineman MJ. (2007) Ovarian stimulation protocols (anti-oestrogens, gonadotrophins with and without GnRH agonists/antagonists) for intrauterine insemination (IUI) in women with subfertility. Cochrane Database Syst Rev. 18;(2):CD005356.
Cohlen BJ, Vandekerckhove P, te Velde ER, Habbema JD. (2007) Timed intercourse versus intra-uterine insemination with or without ovarian hyperstimulation for subfertility in men. Cochrane Database Syst Rev. 2000;(2):CD000360. Review. Update in: Cochrane Database Syst Rev.;(3):CD000360.
Crosignani PG, Somigliana E; (2007) Intrauterine Insemination Study Group. Effect of GnRH antagonists in FSH mildly stimulated intrauterine insemination cycles: a multicentre randomized trial.Hum Reprod. 22(2):500-5.
Custers IM, Steures P, Hompes P, Flierman P, van Kasteren Y, van Dop PA, van der Veen F, Mol BW. (2008) Intrauterine insemination: how many cycles should we perform? Hum Reprod. 23(4):885-8.
Dhaliwal LK, Sialy RK, Gopalan S, Majumdar S. (2002) Minimal stimulation protocol for use with intrauterine insemination in the treatment of infertility. J Obstet Gynaecol Res. 28(6):295-9.
Erdem A, Erdem M, Atmaca S, Guler I. (2008) Impact of luteal phase support on pregnancy rates in intrauterine insemination cycles: a prospective randomized study. Fertil Steril. 8. (Epub ahead of print)
Gerli S, Casini ML, Unfer V, Costabile L, Mignosa M, Di Renzo GC. (2004a) Ovulation induction with urinary FSH or recombinant FSH in polycystic ovary syndrome patients: a prospective randomized analysis of cost-effectiveness. Reprod Biomed Online. 9(5):494-9.
Gerli S, Casini ML, Unfer V, Costabile L, Bini V, Di Renzo GC. (2004b) Recombinant versus urinary follicle-stimulating hormone in intrauterine insemination cycles: a prospective, randomized analysis of cost effectiveness. Fertil Steril. 82(3):573-8.
Hughes EG, Collins JA, Gunby J. (1998) A randomized controlled trial of three low-dose gonadotrophin protocols for unexplained infertility. Hum Reprod. 13(6):1527-31.
Kosmas IP, Tatsioni A, Kolibianakis EM, Verpoest W, Tournaye H, Van der Elst J, Devroey P.
Effects and clinical significance of GnRH antagonist administration for IUI timing in FSH superovulated cycles: a meta-analysis. Fertil Steril. 2008 Aug;90(2):367-72.
Matorras R, Recio V, Corcóstegui B, Rodríguez-Escudero FJ. (2000) Recombinant human FSH versus highly purified urinary FSH: a randomized study in intrauterine insemination with husbands' spermatozoa. Hum Reprod. 15(6):1231-4.
Ragni G, Caliari I, Nicolosi A, Arnoldi M, Somigliana E, Crosignani PG. (2006) Preventing hihg-order multiple pregnancies during controlled ovarian hyperstimulation and intrauterine insemination: 3 years’ experience using low-dose recombinant follicle-stimulating hormone and gonadotropin-releasing hormone antagonists. Fertil Steril 85(3):619-24
Sengoku K, Tamate K, Takaoka Y, Morishita N, Ishikawa M. (1994) A randomized prospective study of gonadotrophin with or without gonadotrophin-releasing hormone agonist for treatment of unexplained infertility. Hum Reprod. 9(6):1043-7.
The ESHRE Capri Workshop Group. (2009) INTRAUTERINE INSEMINATION. Hum Reprod Update. 1(1):1-13.
Verhulst SM, Cohlen BJ, Hughes E, Te Velde E, Heineman MJ. (2006) Intra-uterine insemination for unexplained subfertility. Cochrane Database Syst Rev. 18;(4):CD001838.
1 Centro Sterilità, Fondazione Policlinico
2 Università degli studi di Milano
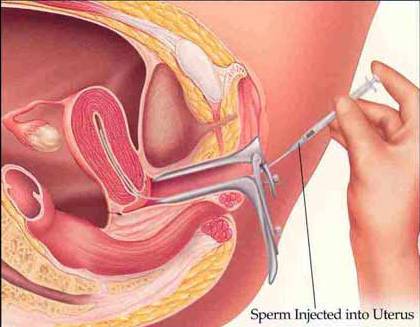
Figura 1: Immagine di una inseminazione intrauterina
Tabella 1: Confronto tra Anti-estrogeni e Gonadotropine: probabilità di gravidanza per coppia
Autori | Gonadotropine n/N | Anit-estrogeni n/N | Odds Ratio |
Balasch 1994 | 12/50 | 4/50 | 3.63 (IC95% :1.08-12.18) |
Dankert 2006 | 17/67 | 19/71 | 0.93 (IC95% :0.43-1.99) |
Ecochard 2000 | 3/29 | 6/29 | 0.44 (IC95% :0.10-1.97) |
Kamel 1995 | 4/28 | 2/26 | 2.00 (IC95% :0.33-11.97) |
Karlstrom 1993 | 3/15 | 1/17 | 4.00 (IC95% :0.37-43.38) |
Karlstrom 1998 | 8/40 | 4/34 | 1.88 (IC95% :0.51-6.88) |
Matorras 2002 | 30/49 | 16/51 | 3.45 (IC95% :1.51-7.88) |
Totale (IC95%) | 278 | 278 | 1.76 (IC95% :1.16-2.66) |
Tabella 2: Confronto tra diversi dosaggi di Gonadotropine: probabilità di gravidanza per ciclo
Autori | Alte dosi | Basse dosi | Odds ratio |
Dhaliwal 2002 | 39/100 | 35/100 | 1.19 ( IC95%: 0.67-2.11) |
Sengoku 1999 | 7/48 | 7/49 | 1.02 (IC95%: 0.33-3.18) |
Totale (IC95%) | 148 | 149 | 1.15 (IC95%:0.69-1.92) |
Tabella 3: Percentuali di gravidanze multiple in cicli di IUI con terapia a basse dosi (Ragni et al., 2006) |
Tabella 4: Confronto tra percentuali di gravidanza in pazienti sottoposte a IUI con utilizzo di GnRH antagonisti e senza
Autori | GnRH antagonista | Senza GnRH antagonista | Odds ratio |
Williams 2004 | 12% | 7% | 1.6 (IC95%:0.5 - 5.5) |
Gomez-Palomares 2005 | 38% | 14% | 3.6 ( IC95%1.2 - 10.6) |
Checa 2006 | 20% | 12% | 1.8 ( IC95%:0.5 - 6.7) |
Lambalck 2006 | 14% | 16% | 0.9( IC95%:0.4 - 1.9) |
Matorras 2006 | 16% | 17% | 0.9( IC95%:0.5 - 1.8) |
Crosignani 2007 | 12% | 13% | 1.0( IC95%:0.5 - 1.9) |
Allegra 2007 | 19% | 10% | 2.1( IC95%:1.1 - 4.2) |
Gomez-Palomares 2007 | 23% | 11% | 2.4( IC95%:1.4 – 4.3) |
Totale | 18% | 13% | 1.5( IC95%:1.2 - 2.0) |

