Impatto della chirurgia dell’endometriosi ovarica sulla riserva follicolare
Maurizio Guido, Daniela Romualdi, Luigi Selvaggi, Simona De Cicco,
Valeria Tagliaferri, Alessandro Bompiani, Antonio Lanzone.
Per endometriosi si intende la presenza di tessuto endometriale, nelle sue componenti ghiandolare e stromale, in sedi differenti dalla cavità uterina. È una patologia che interessa circa il 10% della popolazione femminile in età fertile e rientra tra le principali cause di infertilità. Le sedi maggiormente interessate da questa malattia sono rappresentate dai legamenti utero-sacrali, ovaie, tube e peritoneo pelvico ma il tessuto endometriale può impiantarsi anche in sedi extrapelviche tra cui il pericardio, la pleura e talora l’encefalo. 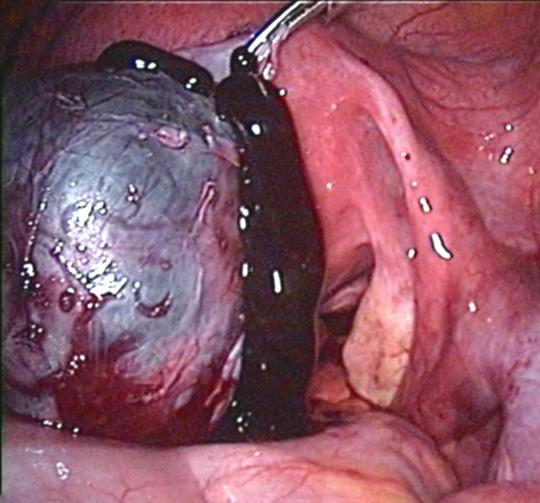
L’ovaio è tra gli organi maggiormente colpiti e presenta una lesione del tutto peculiare, detta endometrioma o “cisti cioccolato” (Figura 1). L’endometrioma è in realtà una “psedocisti”, che deriva dall’invaginazione su base fibrotica di focolai endometriosici presenti sulla superficie ovarica; il conseguente accumulo di materiale ematico è responsabile della caratteristica trasformazione cistica (Giudice et al, 2004).
Figura 1: cisti endometriosica
Il trattamento dell’endometrioma dovrebbe essere il più possibile personalizzato e la scelta tra approccio chirurgico e/o medico dovrebbe considerare una serie di fattori, tra cui età della donna, desiderio di prole, presenza di infertilità, dimensioni della cisti e l’impatto della malattia sulla qualità di vita delle pazienti. Non ci sono studi in letteratura che abbiano comparato direttamente la terapia medica e quella chirurgica per cui mancano evidenze sulla superiorità dell’uno o dell’altro trattamento. Secondo le attuali linee guida, le indicazioni alla terapia chirurgica dell’endometriosi ovarica sono rappresentate dalla presenza di sintomatologia dolorosa importante, infertilità e cisti di diametro > 4 cm anche in assenza di sintomatologia rilevante (Vercellini et al, 1997; Busacca et al, 2009).
L'approccio chirurgico meno invasivo e meno costoso è come sempre da preferire. La laparoscopia risulta quindi la metodica di scelta, poiché diminuisce i costi, la morbidità e l'incidenza di aderenze postoperatorie rispetto alla laparotomia, tuttavia la sicurezza di questo intervento in termini di danno alla riserva ovarica, in termini di alterazione del patrimonio follicolare residuo, è al momento oggetto di discussione.
I potenziali effetti negativi sulla riserva ovarica associati al trattamento chirurgico sono stati accuratamente investigati negli ultimi anni e molti studi hanno valutato l’outcome chirurgico in termini di tassi di gravidanza e di risposta ovarica alla stimolazione con gonadotropine (Somigliana et al, 2006; Tsoumpou et al, 2009; Canis et al, 2001; Benaglia et al, 2009). Alcuni autori, confrontando pazienti con endometrioma operate e non, non hanno riscontrato differenze significative nella risposta ovarica alla stimolazione con gonadotropine (Nargund et al, 1995; Loh et al, 1999). Il bias di questi studi consiste nel fatto che l’endometriosi ovarica è nella gran parte dei casi unilaterale (72-81%) (Vercellini et al, 1998; Al-fozan et al, 2003) ed in queste donne l’ovaio controlaterale sano è in grado nella maggior parte dei casi di compensare adeguatamente la ridotta funzione della gonade affetta (Lass et al, 1999). Nelle tecniche di fecondazione in vitro, invece, è possibile valutare la riserva funzionale di una singola gonade, utilizzando come controllo l’ovaio sano controlaterale della stessa paziente (Ragni et al, 2005; Somigliana et al, 2003). Negli ultimi anni numerosi studi hanno evidenziato come la risposta ovarica a protocolli di COH (controlled ovarian hyperstimulation) nella gonade sottoposta ad escissione laparoscopica dell’endometrioma sia notevolmente ridotta, sia in termini di diminuzione dei follicoli dominanti ottenuti, che nel recupero ovocitario (Figura 2) (Ragni et al, 2005; Somigliana et al, 2003; Ho et al, 2002). Questo dato assume un’importanza cruciale in donne che devono sottoporsi ad intervento chirurgico per endometriosi bilaterale; in queste pazienti, infatti, l’asportazione delle cisti endometriosiche potrebbe comportare un rischio elevato di insufficienza ovarica post-chirurgica (Busacca et al, 2006).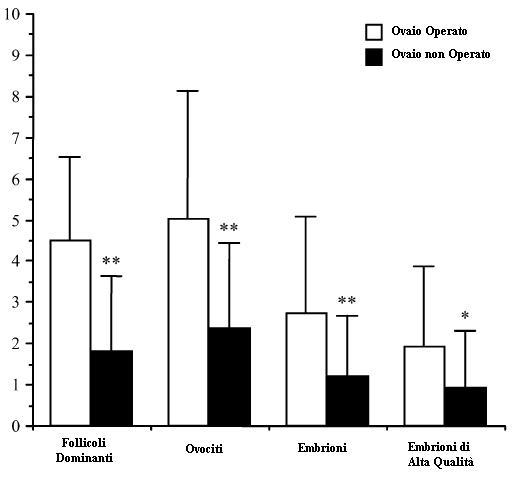
Figura 2: numero di follicoli dominanti, ovociti, embrioni ed embrioni di alta qualità nell’ovaio operato e nel controlaterale intatto. Le gonadi sane sono rappresentate in bianco e le ovaie affette sono rappresentate in nero. Tutte e quattro le variabili sono risultate significativamente differenti. * p=0.005; ** p<0.001.
Ragni et al AJOG 2005
L’entità del danno ovarico associato alla chirurgia sembra essere influenzata da una numerosa serie di fattori. La dimensione dell’endometrioma escisso è uno dei principali parametri analizzati. In molti studi è stato osservato come la riduzione del numero dei follicoli dominanti sia pronunciata in cisti di grandi dimensioni, ma è interessante notare come il danno alla riserva ovarica sia presente anche in caso di escissione di cisti di diametro < 3 cm (Somigliana et al, 2006).
Una seconda variabile da tenere in considerazione è il tipo di approccio chirurgico. Come già sottolineato, attualmente la chirurgia laparoscopica è considerata il “gold standard” per il trattamento dell’endometrioma (Chapron et al, 1998; Muzii et al, 2007; Muzii et al, 2002), tuttavia da un punto di vista di tecnica chirurgica c’è un grande dibattito in letteratura su quale sia la metodica più appropriata per preservare l’outcome riproduttivo della donna e garantirle un basso indice di recidiva (Hart et al, 2005; Muzii et al, 2002; Donnez et al, 1996).
La tecnica di ablazione della cisti endometrosica mediante drenaggio del contenuto cistico e successiva coagulazione della parete, sia mediante vaporizzazione laser sia mediante coagulazione bipolare, è stata da anni abbandonata (Vercellini et al, 1992); infatti questa procedura è associata ad un’importante reazione infiammatoria, oltre che ad una compromissione vascolare locale del parenchima ovarico adiacente, con una notevole ripercussione a carico del pool follicolare della gonade (Velasco et al, 2009; Somigliana et al, 2003; Hart et al, 2005). Inoltre, questa tecnica è stata correlata ad un’incompleta asportazione del tessuto endometriosico con un aumentato tasso di recidiva per la donna rispetto all’escissione della parete cistica (Muzii et al, 2007; Hart et al, 2005; Beretta et al, 1998).
L’escissione mediante “stripping” della parete della cisti endometriosica è stata spesso messa in discussione nel corso degli anni in quanto associata a rimozione di tessuto ovarico sano adiacente la parete dell’endometrioma, con potenziale riduzione della riserva follicolare (Donnez et al, 1996). Muzii et al hanno, infatti, dimostrato come una piccola rima di tessuto ovarico contenente follicoli primordiali è rimossa in più del 50% degli endometriomi (Muzii et al, 2007; Muzii et al, 2002). D’altro canto, la tecnica dell’escissione della cisti con la procedura di “stripping” rappresenta senza dubbio il trattamento più completo dell’endometrioma e nei campioni istologici esaminati non è stato ritrovato tessuto endometriosico residuo (Muzii et al, 2007; Muzii et al, 2002). Infatti, sembrerebbe che il piano di clivaggio creato durante la procedura dello “stripping” segua l’interfaccia tra la capsula fibrotica e il normale tessuto ovarico, favorendo la completa rimozione dell’endometriosi (Muzii et al, 2007). Inoltre la procedura dello stripping non sembra rappresentare un “overtreatment”, poiché il tessuto che viene escisso con l’endometrioma è per lo più tessuto fibrotico e la quota di tessuto ovarico presente nella parete della cisti rimossa non sembra avere le caratteristiche istologiche e, soprattutto, funzionali di un ovaio normale (Muzii et al, 2007).
Un ulteriore fattore che taluni hanno analizzato è lo spessore della parete dell’endometrioma asportato e la sua possibile correlazione con l’alterazione del pool follicolare residuo, ma i dati sono molto limitati e piuttosto discordanti (Muzii et al 2007; Donnez et al, 1996). Alcuni autori hanno dimostrato come la porzione di parenchima ovarico escisso assieme alla parete cistica sia localizzato nella maggior parte dei casi a livello della porzione più spessa della cisti (Muzii et al, 2007). Inoltre, la quantità di tessuto ovarico inavvertitamente asportato con l’endometrioma è maggiore quando la cisti è localizzata nell’ilo ovarico: in circa il 70 % dei campioni dell’ilo sono stati ritrovati follicoli ad uno stadio di sviluppo funzionale più avanzato (Muzii et al, 2005). A tale livello, nondimeno, un’eccessiva trazione sulla parete dell’endometrioma potrebbe determinare la lacerazione dei vasi ilari con un aumentato danno determinato dalla successiva coagulazione del parenchima ovarico (Muzii et al, 2005; Muzii et al, 2007).
In quest’ampio spettro di discussione non si può dimenticare che, ad oggi, non esistono dati chiari in letteratura riguardanti l’eventuale preesistenza alla procedura chirurgica di una riduzione della riserva ovarica in presenza di endometrioma. Infatti, sulla base delle attuali conoscenze, non può essere escluso che la cisti per se determini un danno del parenchima ovarico che la circonda, ad esempio attraverso la produzione di sostanze tossiche che possono compromettere la qualità degli ovociti (Yanushpolsky et al, 1998). È stato dimostrato che il tessuto adiacente l’endometrioma sia interessato da significative alterazioni morfologiche all’esame istologico, che possono essere espressione di un’alterazione funzionale. In particolare, diversi autori hanno osservato un ridotto numero di follicoli in sezioni di corticale ovarica adiacenti alla cisti endometriosica (Maneschi et al, 1993; Muzii et al, 2002). Di notevole interesse è l’assenza di riscontro di queste alterazioni istologiche nel parenchima ovarico adiacente a cisti ovariche di altra natura, come teratomi maturi e cistoadenomi (Muzii et al, 2002; Maneschi et al, 1993; Maneschi et al, 1993). Inoltre, Somigliana et al in un recente lavoro hanno dimostrato come la presenza nella gonade di endometriomi, anche se di piccole dimensioni (21±7 mm), determina una ridotta risposta alle gonadotropine (circa il 25% in meno di follicoli codominanti) (Somigliana et al, 2006).
In conclusione, l’endometriosi ovarica è una patologia che colpisce soprattutto donne in età riproduttiva con il desiderio di preservare la propria fertilità e di ottenere una gravidanza dopo il trattamento chirurgico; quindi, l'obiettivo della chirurgia è duplice poiché mirato sia all’asportazione in toto della cisti endometriosica sia a preservare il più possibile il pool follicolare della gonade affetta.
Sebbene in letteratura ci sia un generale consenso nel raccomandare l’escissione laparoscopica della parete dell’endometrioma (Hart et al, 2005) persistono, ancora oggi, numerosi dubbi. In particolare, persiste la necessità di studiare in maniera più approfondita il danno causato sia dell’endometrioma per se sia dalla chirurgia laparoscopica, al fine di determinare il managment più adeguato per l’endometriosi ovarica garantendo alla paziente il miglior approccio, il più possibile personalizzato, in termini sia di radicalità chirurgica sia di outcome riproduttivo futuro.
BIBLIOGRAFIA
Al-Azemi M, Bernal AL, Steele J, Gramsbergen I, Barlow D, Kennedy S. Ovarian response to repeated controlled stimulation in in-vitro fertilization cycles in patients with ovarian endometriosis. Hum Reprod 2000;15:72-5.
Alborzi S, Momtahan M, Parsanezhad ME, Dehbashi S, Zolghadri J, Alborzi S. A prospective, randomized study comparing laparoscopic ovarian cystectomy versus fenestration and coagulation in patients with endometriomas. Fertil Steril 2004;82:1633–7.
Al-Fozan H, Tulandi T. Left lateral predisposition of endometriosis and endometrioma. Obstet Gynecol. 2003 Jan;101(1):164-6.
Benaglia L, Somigliana E, Vercellini P, Abbiati A, Ragni G, Fedele L. Endometriotic ovarian cysts negatively affect the rate of spontaneous ovulation. Hum Reprod. 2009 Sep;24(9):2183-6. Epub 2009 Jun 5.
Beretta P, Franchi M, Ghezzi F, Busacca M, Zupi E, Bolis P. Randomized clinical trial of two laparoscopic treatments of endometriomas: cystectomy versus drainage and coagulation. Fertil Steril. 1998 Dec;70(6):1176-80.
Busacca M, Vignali M. Endometrioma excision and ovarian reserve: a dangerous relation. J Minim Invasive Gynecol. 2009 Mar-Apr;16(2):142-8.
Busacca M, Riparini J, Somigliana E, Oggioni G, Izzo S, Vignali M, Candiani M. Postsurgical ovarian failure after laparoscopic excision of bilateral endometriomas Am J Obstet Gynecol. 2006 Aug;195(2):339-40.
Canis M, Pouly JL, Tamburro S, Mage G, Wattiez A, Bruhat MA. Ovarian response during IVF-embryo transfer cycles after laparoscopic ovarian cystectomy for endometriotic cysts of >3 cm in diameter Hum Reprod. 2001 Dec;16(12):2583-6.
Chapron C, Querleu D, Bruhat MA, Madelenat P, Fernandez H, Pierre F, Dubuisson JB.Surgical complications of diagnostic and operative gynaecological laparoscopy: a series of 29,966 cases. Hum Reprod. 1998 Apr;13(4):867-72.
Donnez J, Nisolle M, Gillet N, Smets M, Bassil S, Casanas-Roux F. Large ovarian endometriomas. Hum Reprod. 1996 Mar;11(3):641-6.
Donnez J, Wyns C, Nisolle M. Does ovarian surgery for endometriomas impair the ovarian response to gonadotropin? Fertil Steril. 2001 Oct;76(4):662-5.
Giudice LC, Kao 1. LC. Endometriosis. Lancet 2004;364:1789-99.
Gupta S, Agarwal A, Agarwal R, Loret de Mola JR. Impact of ovarian endometrioma on assisted reproduction outcomes. Reprod Biomed Online 2006;13:349–360.
Hachisuga T, Kawarabayashi T. Histopathological analysis of laparoscopically treated ovarian endometriotic cysts with special reference to loss of follicles. Hum Reprod 2002;17:432-5.
Hart R, Hickey M, Maouris P, Buckett W, Garry R.Excisional surgery versus ablative surgery for ovarian endometriomata: a Cochrane Review. Hum Reprod. 2005 Nov;20(11):3000-7. Review.
Ho HY, Lee RK, Hwu YM, Lin MH, Su JT, Tsai YC. Poor response of ovaries with endometrioma previously treated with cystectomy to controlled ovarian hyperstimulation. J Assist Reprod Genet. 2002 Nov;19(11):507-11.
Horikawa T, Nakagawa K, Ohgi S, Kojima R, Nakashima A, Ito M, Takahashi Y, Saito H. The frequency of ovulation from the affected ovary decreases following laparoscopic cystectomy in infertile women with unilateral endometrioma during a natural cycle. J Assist Reprod Genet 2008;25:239–244.
Lass A. The fertility potential of women with a single ovary.Hum Reprod Update. 1999 Sep-Oct; 5(5):546-50.
Loh FH, Tan AT, Kumar J, Ng SC. Ovarian response after laparoscopic ovarian cystectomy for endometriotic cysts in132 monitored cycles. Fertil Steril 1999;72:316–321.
Loo TC, Lin MY, Chen SH, Chung MT, Tang HH, Lin LY, Tsai YC Endometrioma undergoing laparoscopic ovarian cystectomy: its influence on the outcome of in vitro fertilization and embryo transfer (IVF-ET). J Assist Reprod Genet. 2005 Oct;22(9-10):329-33.
Maneschi F, Marasá L, Incandela S, Mazzarese M, Zupi E. Ovarian cortex surrounding benign neoplasms: a histologic study. Am J Obstet Gynecol. 1993 Aug;169(2 Pt 1):388-93.
Muzii L, Bianchi A, Crocè C, Manci N, Panici PB. Laparoscopic excision of ovarian cysts: is the stripping technique a tissue-sparing procedure? Fertil Steril. 2002 Mar;77(3):609-14.
Muzii L, Bellati F, Palaia I, Plotti F, Manci N, Zullo MA, Angioli R, Panici PB. Laparoscopic stripping of endometriomas: a randomized trial on different surgical techniques. Part I: clinical results. Hum Reprod. 2005 Jul;20(7):1981-6. Epub 2005 Mar 31.
Muzii L, Bellati F, Bianchi A, Palaia I, Manci N, Zullo MA, Angioli R, Panici PB. Laparoscopic stripping of endometriomas: a randomized trial on different surgical techniques. Part II: pathological results. Hum Reprod. 2005 Jul;20(7):1987-92. Epub 2005 Apr 28.
Muzii L, Bianchi A, Bellati F, Cristi E, Pernice M, Zullo MA, Angioli R, Panici PB. Histologic analysis of endometriomas: what the surgeon needs to know Fertil Steril. 2007 Feb;87(2):362-6. Epub 2006 Nov 13.
Nargund G, Parsons J. Infected endometriotic cysts secondary to oocyte aspiration for in-vitro fertilization Hum Reprod. 1995 Jun;10(6):1555.
Ragni G, Somigliana E, Benedetti F, Paffoni A, Vegetti W, Restelli L, Crosignani PG. Damage to ovarian reserve associated with laparoscopic excision of endometriomas: A quantitative rather than a qualitative injury. American Journal of Obstetrics and Gynecology (2005) 193, 1908–14.
Somigliana E, Infantino M, Benedetti F, Arnoldi M, Calanna G, Ragni G. The presence of ovarian endometriomas is associated with a reduced responsiveness to gonadotropins. Fertil Steril. 2006 Jul;86(1):192-6. Epub 2006 May 23.
Somigliana E, Ragni G, Benedetti F, Borroni R, Vegetti W, Crosignani PG. Does laparoscopic excision of endometriotic ovarian cysts significantly affect ovarian reserve? Insights from IVF cycles. Hum Reprod. 2003 Nov;18(11):2450-3.
Suzuki T, Izumi S, Matsubayashi H, Awaji H, Yoshikata K, Makino T. Impact of ovarian endometrioma on oocytes and pregnancy outcome in in vitro fertilization. Fertil Steril. 2005 Apr;83(4):908-13.
Takuma N, Sengoku K, Pan B, Wada K, Yamauchi T, Miyamoto T, et al. Laparoscopic treatment of endometrioma-associated infertility and pregnancy outcome. Gynecol Obstet Invest 2002; 54: 30–5.
Tsoumpou I, Kyrgiou M, Gelbaya TA, Nardo LG. The effect of surgical treatment for endometrioma on in vitro fertilization outcomes: a systematic review and meta-analysis Fertil Steril. 2009 Jul;92(1):75-87. Epub 2008 Aug 9. Review.
Velasco JG and Somigliana E. Management of endometriomas in women requiring IVF: to touch or not to touch Human Reproduction, Vol.24, No.3 pp. 496–501, 2009.
Vercellini P, Vendola N, Bocciolone L, Colombo A, Rognoni MT, Bolis G. Laparoscopic aspiration of ovarian endometriomas. Effect with postoperative gonadotropin releasing hormone agonist treatment. J Reprod Med. 1992 Jul;37(7):577-80.
Vercellini P, Chapron C, De Giorgi O, Consonni D, Frontino G, Crosignani PG. Coagulation or excision of ovarian endometriomas? Am J Obstet Gynecol 2003;188:606-10.
Vercellini P. Endometriosis: what a pain it is. Semin Reprod Endocrinol. 1997;15(3):251-61. Review.
Vercellini P, Aimi G, De Giorgi O, Maddalena S, Carinelli S, Crosignani PG. Is cystic ovarian endometriosis an asymmetric disease? Br J Obstet Gynaecol. 1998 Sep;105(9):1018-21.
Vicino M, Scioscia M, Resta L, Marzullo A, Ceci O, Selvaggi LE. Fibrotic tissue in the endometrioma capsule: surgical and physiopathologic considerations from histologic findings. Fertil Steril. 2009 Apr;91(4 Suppl):1326-8. Epub 2008 Apr 14.
Yanushpolsky EH, Best CL, Jackson KV, Clarke RN, Barbieri RL, Hornstein MD. Effects of endometriomas on ooccyte quality, embryo quality, and pregnancy rates in in vitro fertilization cycles: a prospective, case-controlled study. J Assist Reprod Genet. 1998 Apr;15(4):193-7.
Dipartimento per la Tutela della Salute della Donna e della Vita Nascente - Università Cattolica Sacro Cuore – Roma

