Effetti delle procedure di vitrificazione sulla conservazione dell’ovocita di ovino utilizzato come modello animale
Naitana S1., Leoni GG2., Berlinguer F1., Succu S2., Satta V2., Bogliolo L3., Bebbere D3., Ledda S3
Introduzione
La conservazione a lungo termine del gamete femminile è uno dei più validi mezzi per il miglioramento dei programmi di selezione genetica negli allevamenti e per lo sviluppo delle biotecnologie riproduttive per scopi commerciali, terapeutici e di ricerca sia in campo umano che animale. Inoltre la crioconservazione dell’oocita ha anche notevole importanza nella protezione dell’integrità genetica delle popolazioni locali, nella conservazione del materiale genetico di specie in vie d’estinzione e in generale nel sostenere la biodiversità animale mediante la creazione di banche genetiche di oociti (26, 27, 59).
Recentemente i numerosi progressi nel campo della criobiologia hanno aperto interessanti orizzonti per la crioconservazione di gameti ed embrioni a differenti stadi di sviluppo (4, 16). Comunque la perdita di potenziale di sviluppo dopo crioconservazione rende l’oocita di mammifero uno dei tipi cellulari maggiormente difficili da crioconservare.
Tutti gli oociti evidenziano considerevoli alterazioni strutturali e funzionali durante le procedure di crioconservazione, altamente variabili sia fra le specie che fra gli individui della stessa specie e dipendenti sia dallo stadio di sviluppo che dall’origine in vivo o in vitro del gamete. L’elevata sensibilità dell’oocita alle procedure di crioconservazione potrebbe essere attribuita all’inappropriato rapporto superficie/volume e allo stato fisiologico (46). Infatti sia il gamete femminile immaturo che quello maturo si trovano in una intrinseca condizione sfavorevole per l’applicazione di queste procedure poiché non hanno completato il processo meiotico del ciclo cellulare; in questo stadio il gamete può essere inadatto ad evitare gli insulti esterni e/o a riprendere le attività metaboliche necessarie per riparare le alterazioni morfologiche e biochimiche indotte dalle procedure di crioconservazione.
Attualmente sono utilizzati due metodi per la crioconservazione del gamete femminile: il congelamento e la vitrificazione. Questi metodi mostrano notevoli differenze per quanto riguarda le concentrazioni dei crioprotettori (CPAs), le velocità di raffreddamento e i tempi di esecuzione (tabella 1). Attualmente, la vitrificazione è maggiormente utilizzata in quanto limita l’impatto negativo sul metabolismo energetico e conserva con più efficacia la potenzialità di sviluppo embrionale, come osservato nell’oocita di topo (22). La preferenza per la vitrificazione da parte dei ricercatori può essere dovuta al suo elevato potenziale di sviluppo futuro nel campo della crioconservazione.
|
|
|
|
|
Congelamento lento |
Vitrificazione |
|
|
Costo |
Elevato per apparecchiature |
bassissimo |
|
Concentrazione di CPAs |
~ 5-6 % (v/v) |
~ 40% (v/v) |
|
Tempi di esecuzione |
< 2 ore |
< 10 min |
|
Strumenti di supporto |
paillettes |
OPS, CL, CT, |
|
Volume di caricamento |
5-10 μl |
<1 μl |
|
Gradiente termico |
~ 1 °C/min |
~ 23.000 °C/min |
Tabella 1. Principali differenze tra il congelamento e la vitrificazione
Procedure di vitrificazione
Le alterazioni dell’oocita possono manifestarsi in tutte le fasi delle procedure di crioconservazione: l‘esposizione ai CPAs, le fasi di raffreddamento e di ripristino della temperatura. Le soluzioni di vitrificazione sono generalmente complesse poiché contengono differenti tipi e concentrazione variabili di CPAs, zuccheri, macromolecole e di componenti biologiche e sintetiche (65). Spesso è difficile determinare gli effetti indotti da ciascun componente delle soluzioni di vitrificazione sull’integrità delle cellule. Gli oociti sono prima sospesi ed equilibrati in una soluzione di CPAs a basso peso molecolare che, avendo una minore permeabilità rispetto alle molecole d’acqua, generano disidratazione cellulare durante la fase di esposizione ai CPAs che precede l’abbassamento della temperatura. I CPAs permeabili hanno la capacità di formare legami idrogeno con l’acqua impedendone la cristallizzazione e proteggendo la cellula dagli effetti della disidratazione. I CPAs hanno tuttavia effetti tossici ed osmotici quando utilizzati a concentrazioni efficaci per una efficiente crioconservazione. Essi penetrano attraverso le membrane cellulari in relazione alle loro dimensioni molecolari e alle proprietà della membrana con diverse velocità espresse dal coefficiente di permeabilità. I CPAs maggiormente utilizzati nelle procedure di vitrificazione sono il dimetilsolfossido (DMSO), il glicole etilenico (EG) e il glicole propilenico (PROH) che presentano bassa tossicità ed elevata permeabilità. In genere per limitare la tossicità specifica e per combinare le capacità protettive di ciascun CPA vengono utilizzate delle miscele di queste molecole. Tra i CPAs, il glicole etilenico è quello maggiormente utilizzato per la bassa tossicità, solitamente in associazione con DMSO, anche se nella specie bovina è stato osservato che miscele di EG e PROH si sono rivelate maggiormente efficienti (8). Il PROH ha mostrato maggior coefficiente di permeabilità sulle membrane di oociti maturi di scimmia rispetto al DMSO e al EG (20). La composizione delle membrane cellulari influenza la permeabilità dell’acqua quando le cellule sono esposte a una soluzione anisosmotica ipertonica. La permeabilità di una cellula all’acqua, riferibile alla pressione osmotica tra l’ambiente intra ed extracellulare è chiamata conduttività idraulica. Il flusso idrico della cellula esposta a soluzioni ipertoniche di CPAs è dipendente dalla composizione delle membrane e dalla superficie della membrana (Figura 1).
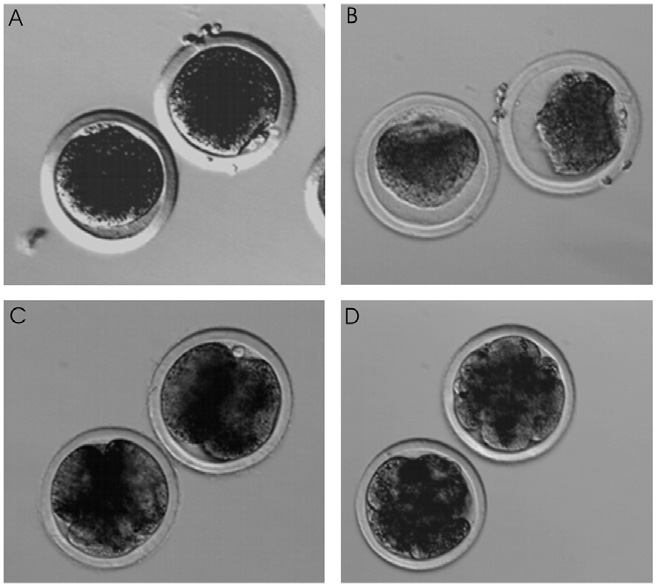
Figura 1. Oociti maturati prima (A) e dopo (B) esposizione a soluzioni di CPAs precedente all’immersione in azoto liquido.
Oociti della stessa specie mostrano differenze individuali nelle loro proprietà di permeabilità alle soluzioni di CPAs, come spermatozoi prelevati da differenti maschi della stessa specie possono mostrare significative differenze nella risposta alle procedure di crioconservazione. Van der Abbeel (61) ha messo in evidenza significative differenze nelle proprietà osmotiche di oociti derivanti dallo stesso donatore. Le membrane citoplasmatiche sono danneggiate dalla riduzione della temperatura dovuta alla transizione di fase del doppio strato lipidico che altera la struttura e la funzione della membrana plasmatica (67). I dati ottenuti in numerosi esperimenti mostrano che la sensibilità di oociti di mammifero alle alterazioni indotte dalle procedure di vitrificazione differisce tra le specie. Per l’elevato livello di lipidi gli oociti di suino, ovino e bovino sono particolarmente sensibili al raffreddamento mentre gli oociti umani e murini possono tollerare meglio queste alterazioni. Sono state descritte differenze nel numero e nella struttura di vescicole lipidiche tra oociti di bovino e di suino (17). Gli oociti di suino contengono oltre due volte (161 μg) di lipidi totali rispetto all’ovino (89 μg) e tre volte rispetto al bovino (63 μg), (17, 36). Per questa ragione gli oociti di bovino e ovino sono considerati maggiormente resistenti alla crioconservazione rispetto a quelli di suino. Nella ricerca tendente a ridurre il contenuto totale di lipidi sono stati sperimentati metodi di delipidazione meccanica o chimica basati sulla centrifugazione (51) o sull’utilizzo di agenti lipolitici quali la forscolina (37). Inoltre si è cercato di modificare la costituzione dei lipidi di membrana per incrementare il rapporto tra acidi grassi insaturi e saturi nelle membrane (46, 67) mediante l’utilizzo di liposomi o la pianificazione della dieta. In proposito è stato osservato che elevate concentrazioni di acidi grassi insaturi derivati da olio di pesce hanno permesso di aumentare la criotolleranza di oociti di ovino (66).
Il fattore principale che influenza la probabilità di successo della vitrificazione è l’aumento delle velocità di raffreddamento e ripristino della temperatura. E’ stato suggerito che le procedure di vitrificazione possono essere migliorate decrementando il volume del liquido in cui devono essere contenuti gli oociti da crioconservare a meno di 1 μl. Numerosi sistemi di supporto (Cryodevices) sono stati studiati per utilizzare il minimo volume delle soluzioni di vitrificazione, tra i quali le Open Pulled Straws (OPS), cryotop (CT), cryoloop CL), superficie solida di vitrificazione (SSV). Analisi comparative tra CPAs condotte in numerosi laboratori hanno permesso di stabilire che il sistema CT sembrerebbe offrire maggiori potenzialità nel preservare la sopravvivenza dell’oocita e nell’aumentare le percentuali di fertilizzazione e di sviluppo rispetto ad altri cryodevices (31). Un ipotetico rischio di trasmissione di malattie si potrebbe ipotizzare specialmente quando gli oociti sono caricati in sistemi aperti e messi direttamente a contatto con azoto liquido contaminato (6). Di recente, questo inconveniente può essere evitato sterilizzando l’azoto liquido con radiazioni ultraviolette a 253.7 nm (45).
Il ripristino della temperatura
Recentemente numerose ricerche hanno focalizzato i loro studi anche sugli effetti della fase di ripristino della temperatura sulla sopravvivenza di oociti vitrificati. Fortunatamente, i supporti utilizzati oltre che permettere gradienti di raffreddamento molto elevati producono anche gradienti di ripresa della temperatura altrettanto rapidi. Un rapido ripristino della temperatura è essenziale per minimizzare sia la formazione di cristalli di ghiaccio durante i processi di de-vitrificazione sia la loro crescita per processi di ricristallizzazione (49). Per il ripristino della temperatura il campione è direttamente trasferito dall’azoto liquido in una soluzione ipertonica (0.5M) a 37°C contenente macromolecole non permeabili e in successivi passaggi seriali a concentrazioni decrescenti allo scopo di mantenere l’equilibrio tra l’ambiente intra ed extracellulare. Questo processo è essenziale per permettere la rimozione lenta dei CPAs dall’oocita. Solitamente le macromolecole non permeabili utilizzate sono zuccheri come il saccarosio, il trealosio e il raffinosio. La presenza di questi disaccaridi all’interno e all’esterno del citoplasma migliora le capacità di sviluppo di oociti crioconservati (11) e permette la riduzione delle concentrazioni di CPAs nelle soluzioni di crioconservazione (12). È stato evidenziato che la presenza di trealosio nel medium di maturazione in vitro stabilizza le membrane cellulari durante la vitrificazione e il ripristino della temperatura, incrementando la criotolleranza e la successiva capacità di sviluppo di oociti di suino (30) e di ovino (5).
Aspetti morfologici e molecolari
Numerosi studi hanno dimostrato che immediatamente dopo il ripristino della temperatura e durante la successiva fase di coltura in vitro gli oociti e gli embroni vitrificati richiedono un breve periodo di tempo per completare il recupero della loro attività metabolica (28). Durante questo tempo vengono riparate e rese funzionali le strutture e le molecole, che hanno subito danneggiamenti reversibili dopo la crioconservazione
Danneggiamenti morfologici
Oociti vitrificati analizzati immediatamente dopo il ripristino della temperatura mostrano severe alterazioni delle componenti strutturali citoplasmatiche. Il principale bersaglio dell’insulto da abbassamento di temperatura e osmotico è la membrana plasmatica. L’oocita, esposto a soluzioni di vitrificazione iperosmotiche durante la fase di disidratazione, non riesce a mantenere la sua forma e può verificarsi la rottura della membrana plasmatica. Inoltre una delle maggiori alterazioni durante le procedure di vitrificazione è una anomala configurazione del fuso meiotico, causata dalla disorganizzazione e disassemblamento dei microtubuli, descritta in oociti di suino (48), bovino (40), ovino (55) e equino (18, 57). I cromosomi materni durante la metafase II sono allineati da una rete di microtubuli che formano un fuso meiotico funzionale che, durante la fertilizzazione determina la segregazione fisica dei cromosomi e completa il processo meiotico con l’espulsione del secondo globulo polare. L’integrità del fuso meiotico è inoltre necessaria per attivare la degradazione del Maturation Promoting Factor (MPF) alla fertilizzazione.
La stabilizzazione del citoscheletro durante la vitrificazione potrebbe apportare miglioramenti alla sopravvivenza e al successivo sviluppo di oociti crioconservati. La citocalasina B è una molecola che ha la capacità di stabilizzare il citoscheletro rendendolo meno rigido. L’aggiunta di citocalasina B durante la vitrificazione può ridurre il danneggiamento dei microtubuli, aumentare la stabilizzazione del fuso degli oociti maturi e conservare la funzionalità delle gap junctions tra oocita e cellule del cumulo negli oociti immaturi. Risultati positivi sono stati riportati con l’aggiunta di citocalasina alle soluzioni di vitrificazione nel suino (18) e nell’ovino (50). Anche una molecola antitumorale, il taxol, è stata utilizzata come agente stabilizzante del citoscheletro durante le procedure di vitrificazione. L’aggiunta di 1 μl di taxol alle soluzioni di vitrificazione incrementa la capacità di sviluppo di oociti in specie domestiche (41), nella specie umana (14) e murina (44). Comunque opposti risultati sono stati osservati per quanto riguarda la capacità di sviluppo di oociti vitrificati di suino (15), suggerendo che sono necessari ulteriori studi. Una alternativa al loro utilizzo è quella di crioconservare oociti allo stadi di GV in cui si ha una minore sensibilità dei microtubuli citoscheletrici alla temperatura e non è presente il fuso meiotico. Nonostante queste peculiarità sono stati comunque osservati altri tipi di alterazioni quali la frattura della zona pellucida adiacente alle cellule del cumulo, la rottura delle gap junctions e/o la perdita delle comunicazioni tra comparto somatico e germinale e l’inibizione della polimerizzazione della F-actina con conseguente diminuzione delle percentuali di maturazione in oociti vitrificati di suino (18), gatto (32), bovino (48) e ovino (7). Parallelamente è stato dimostrato in oociti equini immaturi che le procedure di vitrificazione diminuivano le comunicazioni tra cellule del cumulo e oocita con un conseguente abbassamento delle percentuali di maturazione. D’altra parte una pur elevata percentuale di cellule del cumulo ooforo apoptotiche non altera le percentuali di maturazione in vitro post vitrificazione (57).
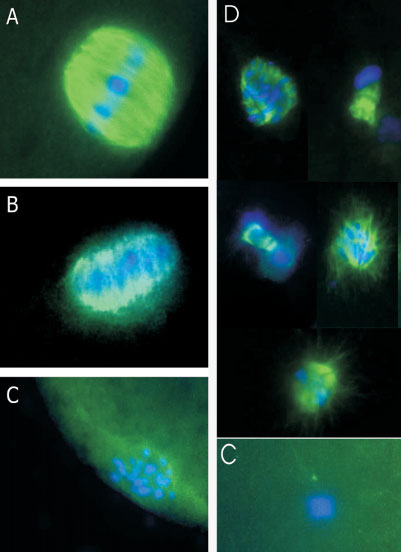
Figura 2. Alterazione del fuso meiotico di oociti crioconservati visualizzati al microscopio a epifluorescenza. A: fuso normale allo stadio di MII (verde) con cromosomi condensati (blu) allineati sul piano equatoriale della struttura; (B) fuso ridotto ; (C) fuso assente; (D) fuso asimmetrico.
La vitrificazione induce profonde modificazioni ultrastrutturali nei mitocondri di oociti di bovino che possono determinare una riduzione della vitalità (47). La funzione primaria dei mitocondri è di generare l’energia richiesta nelle fasi cruciali della ripresa dell’attività metabolica durante la fase di ripristino della temperatura. Nel suino i processi di vitrificazione e ripristino della temperatura causano una anomala distribuzione dei mitocondri (13), rispetto alla dispersione omogenea che si ha prima della fertilizzazione. Nel suino è stata osservata una riduzione del numero dei mitocondri pari al 52% rispetto a oociti non vitrificati (58). Il movimento dei mitocondri nel citoplasma dell’oocita è mediato da una rete di microtubuli citoscheletrici. Le alterazioni dei microtubuli durante la vitrificazione potrebbero influenzare il movimento dei mitocondri alterandone la distribuzione citoplasmatica. I mitocondri di oociti maturi vitrificati di bovino (47) e suino (13) si presentano allungati, con la superficie rugosa, indistinta e rotta, mentre in oociti di equino vitrificati allo stadio di GV i mitocondri si presentano rigonfi (18). Il pretrattamento con Taxol può ripristinare la normale distribuzione mitocondriale in oociti vitrificati di suino (13).
Sfortunatamente la maggior parte degli oociti vitrificati mostra alterazioni irreversibili con aspetti tipici di processi apoptotici. È stato osservato che gli oociti di bovino vitrificati in OPS hanno evidenziato processi di degenerazione durante la coltura post-vitrificazione come attivazione anomala delle caspasi e frammentazione del DNA (38). Queste alterazioni non sono state confermate da altri ricercatori che invece hanno evidenziato frammentazione del DNA solamente durante il congelamento classico ma non durante la vitrificazione (53).
Alterazioni funzionali.
Il mantenimento di un efficiente status ossido riduttivo è cruciale per la sopravvivenza dell’oocita crioconservato. Recentemente è stato rivelato che dopo le fasi di vitrificazione e ripristino della temperatura di oociti maturi di suino i livelli di glutatione (GSH) si riducono e aumentano le concentrazioni di H2O2 rispetto a oociti non vitrificati (52). Il GSH è noto avere un ruolo cruciale nel sistema di difesa antiossidante delle cellule ed una efficiente azione di neutralizzazione dei ROS. La presenza di antiossidanti nelle soluzioni di vitrificazione incrementano le percentuali di sopravvivenza di gameti ed embrioni vitrificati. Nostre esperienze, condotte su oociti di ovino vitrificati allo stadio di MII, hanno permesso di stabilire che i livelli del MPF risultavano significativamente inferiori rispetto agli oociti non vitrificati; mentre il livello delle MAPK non ha mostrato alcuna variazione (55). Al contrario livelli significativamente inferiori di MPF e MAPK sono stati evidenziati in oociti di ovino vitrificato allo stadio di GV (7). Ciò lascia intendere che la sensibilità alle procedure di vitrificazione dell’oocita allo stadio di GV risulta essere maggiore rispetto alla MII.
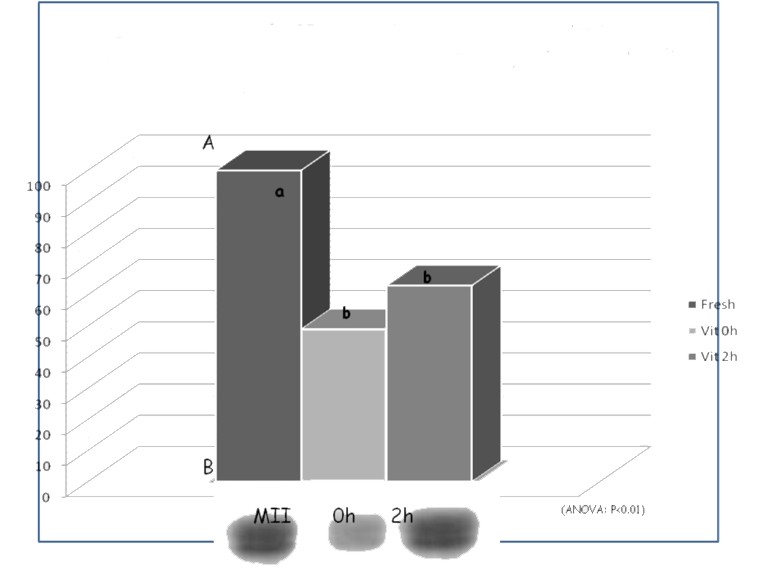
Figura 3. Attività dell’MPF misurata come intensità relative delle bande elettroforetiche ottenute dopo kinase assay sull’Istone H1 in oociti non vitrificati (A) subito dopo la vitrificazione (B) e dopo due ore di coltura in vitro dal ripristino della temperatura.
Allo scopo di valutare l’influenza della crioconservazione sul pattern di RNA messaggeri presenti nell’oocita abbiamo proceduto ad effettuare una analisi quantitativa dell’espressione di un pannello di geni (54). I geni studiati erano coinvolti in vari aspetti della biologia dell’oocita e dell’embrione preimpianto, quali il metabolismo (Na+K+ATPase), la compattazione e la cavitazione (E-Cad), la regolazione del ciclo cellulare (cyclin B and p34cdc2), la risposta agli stress (HSP90β) e alcune delle funzioni costitutive della cellula embrionale (H2A.Z, PAP, ubiquitin, β-actin). I risultati hanno mostrato una minore quantità di alcuni dei geni analizzati negli oociti vitrificati rispetto al controllo (Fig. 3), suggerendo una generale diminuzione del contenuto degli RNA causato dalle procedure di vitrificazione. Queste generale deficienza potrebbe influenzare vari meccanismi molecolari ed essere parzialmente responsabile della bassa capacità di sviluppo del gamete femminile crioconservato (54).
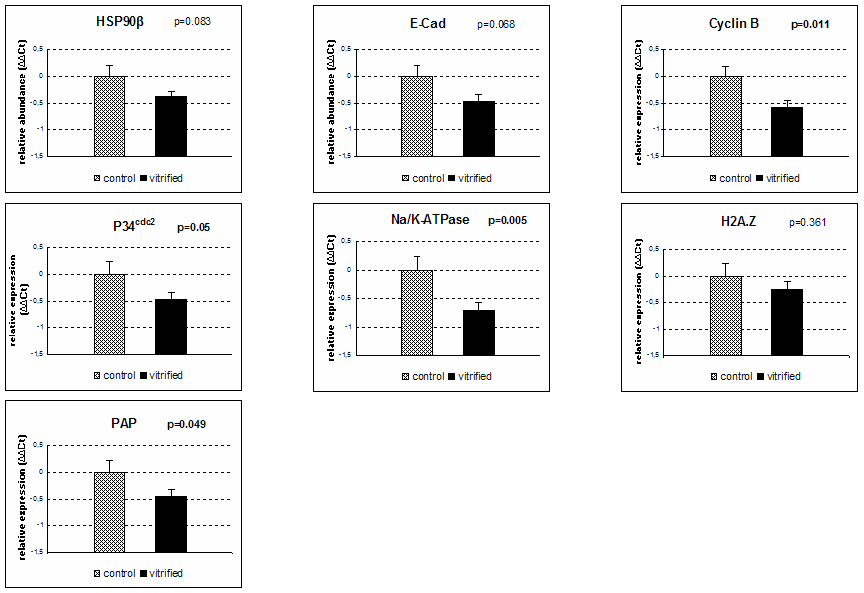
Figura 4. Espressione relative degli mRNA per PAP, Na/K ATPase, E-Caderina, Ciclina B, P34cdc2, HSP90, B-Actina e Istone H2AZ in oociti controllo e vitrificati ottenuta mediante real time PCR.
I mitocondri oltre che avere un ruolo guida nella produzione di ATP sono implicati anche nella omeostasi del calcio intracellulare. Il calcio è un segnale intracellulare deputato al controllo di svariati processi metabolici della cellula. L’assenza di fluttuazioni citoplasmatiche di questo elemento e il suo mantenimento a livelli elevati potrebbe compromettere alcune funzioni della cellula. È stato descritto che sia l’incremento delle concentrazione di calcio che il rilascio del citocromo C dalle membrane mitocondriali nel citoplasma sono coinvolti nella modulazione di fattori cellulari preapoptotici che attivano le caspasi. Inoltre le oscillazioni delle concentrazione del calcio sono coinvolte nella regolazione dell’MPF mediante degradazione della ciclina B1 e nella ripresa del ciclo meiotico negli oociti maturi (35), nel reclutamento di mRNA materni e nella regolazione dell’espressione genica globale nelle blastocisti (43).
È stato osservato che con l’esposizione di oociti ad un abbassamento termico di 14 °C (33) si registra un incremento dei livelli intracitoplasmatici di calcio. Allo stesso modo l’esposizione degli oociti a soluzioni di CPAs determina un transiente incremento delle concentrazioni di calcio intracellulare. È stato osservato inoltre in oociti murini che la presenza di PROH e EG nelle soluzioni di vitrificazione aumentano le concentrazioni intracellulari di calcio agendo sui flussi dall’ambiente extracellulare; il DMSO influenza le riserve intracellulari di calcio agendo direttamente sui mitocondri e sul reticolo endoplasmatico (23), suggerendo che il DMSO potrebbe essere il CPA meno adatto per la vitrificazione dell’oocita. Pertanto l’incremento delle concentrazioni di calcio intracitoplasmatico che si registrano nell’oocita durante la vitrificazione è probabilmente dovuto a un effetto cumulativo sia dei CPAs che dell’abbassamento della temperatura. Il blocco dei flussi di calcio attraverso la membrana plasmatica attuato mediante la rimozione del calcio dalle soluzioni di vitrificazione e il contemporaneo blocco del rilascio dalle riserve intracellulari mediante l’utilizzo di agenti chelanti migliora la vitalità di oociti esposti a soluzioni di vitrificazione e incrementa la capacità di sviluppo di oociti (24, 29). L’aumento delle concentrazioni di calcio intracellulare dopo esposizione ai CPAs potrebbe mimare il processo partenogenetico come mostrato in oociti maturi di ovino (58) e di suino (52). Da nostri dati non ancora pubblicati si può mettere in evidenza che la riduzione delle concentrazioni di calcio nelle soluzioni di vitrificazione determina una riduzione delle percentuali di attivazione partenogenetica spontanea.
|
Ca++ nel medium di vitrificazione |
N° oociti |
Attivazione partenogenetica |
|
99 mg/l |
80 |
33(41.2%)a |
|
67 mg/l |
66 |
21(31.8%)ac |
|
76 mg/l |
62 |
15 (24.2%)bc |
|
0.9 mg/l |
80 |
11 (12.5%)bf |
|
1.1 mg/l |
74 |
6 (8.1%)def |
Tabella 2. Influenza delle concentrazioni di Ca++ nelle soluzioni di vitrificazione sulla attivazione partenogenetica spontanea di oociti di ovino maturati in vitro.
Strategie per il miglioramento della capacità di sviluppo di oociti vitrificati
L’effetto cumulativo delle alterazioni strutturali e funzionali potrebbe essere responsabile delle ridotte percentuali di divisione embrionale e del limitato numero di blastocisti derivate da oociti vitrificati. I risultati sono molto differenti tra le varie specie di mammifero, in funzione della sensibilità alle procedure di crioconservazione e alla scarsa efficienza delle tecnologie di produzione embrionale in vitro nel supportare con efficacia lo sviluppo di oociti vitrificati. In particolare nelle specie equine e canine il successo della crioconservazione dell’oocita rimane bassa se comparato ad altre specie come quella bovina e umana. Risultati deludenti sono stati ottenuti anche vitrificando oociti di suino (15) o ovino (7) allo stadio di GV o quelli derivati da animali prepuberi (56). Una strategia vincente potrebbe essere quella di trasferire gli oociti vitrificati, dopo il ripristino della temperatura nell’ovidotto di animali riceventi senza ricorrere alla coltura in vitro, come suggerito da Lazzari e coll. (25).
|
|
oociti fertilizzati |
divisi (%) |
blastocisti (%) |
|||||
|
26°h |
32°h |
totale |
6 gpf* |
7 gpf* |
8 gpf* |
totale |
||
|
controllo |
140 |
63 (60.0)a |
42 (40.0)a |
105 (75.0) |
27 (47.4) |
21 (36.8) |
9 (15.8) |
57 (54.3)a |
|
vitrificati |
113 |
13 (27.6)b |
34 (72.3)b |
47 (41.6) |
0 |
6 (75) |
2 (25) |
8 (17.2)b |
Tabella 3. Tempi di divisione embrionale e capacità di sviluppo di embrioni derivati da oociti di ovino maturati in vitro e vitrificati. * Giorni post-fertilizatione.
Gli embrioni derivati da oociti vitrificati sono di una bassissima qualità come dimostrato dal ridotto numero cellulare, dalla ridotta capacità di impiantarsi e dare origine a gravidanze dopo trasferimento in riceventi se paragonate alle performances dei corrispondenti embrioni derivati da oociti non crioconservati (3, 39, 62). Il primo indicatore della scarsa qualità embrionale potrebbe essere la lunghezza maggiore dei primi cicli mitotici e il conseguente ritardo nella prima divisione embrionale e della formazione della blastocisti, come già osservato nell’ovino (tabella 3).Sicuramente la scarsa qualità delle blastocisti derivate da oociti vitrificati ha conseguenze dirette sulle percentuali di gravidanza e sulla vitalità neonatale, come riportato nelle specie bovina (63), umana (21), equina (34) e murina (3).
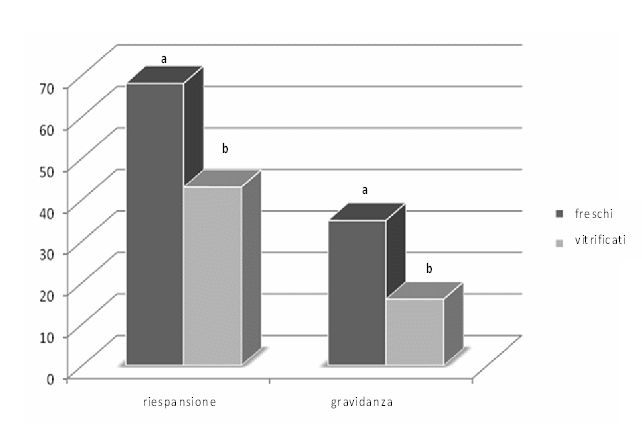
Figura 5. Vitalità e percentuali di gravidanza di blastocisti crioconservate derivate da oociti di ovino maturati in vitro freschi e vitrificati.
É stato suggerito che una temporanea esposizione a stress quale per esempio il pretrattamento con elevate concentrazioni di NaCl incrementa la criotolleranza e la capacità di sviluppo come dimostrato per oociti di suino (30). Il miglioramento della criotolleranza e la capacità di sviluppo di oocito dopo uno stress temporaneo potrebbe essere mediato da meccanismi che coinvolgono le heat shock proteins (HSPs). Stress ambientali potrebbero evocare la produzione di HSPs, le proteine maggiormente conservate coinvolte nel recupero delle strutture cellulari danneggiate. In un precedente studio abbiamo osservato un incremento della sintesi di HSPs negli embrioni di ovino in seguito a stress termici (29). Più recentemente è stato suggerito un ulteriore approccio che prevede il miglioramento delle procedure di vitrificazione mediante il pretrattamento degli embrioni con elevate pressioni idrostatiche (HHP). L’utilizzo del pretrattamento con HHP su oociti di suino incrementa la capacità di sviluppo di oociti vitrificati probabilmente mediante una stabilizzazione post trascrizionale degli mRNA per HSP70 (9).
Conclusioni
La crioconservazione dell’oocita è ancora da considerare una procedura sperimentale. La mancanza di opportunità per il transfer diretto di oociti vitrificati in riceventi sincrone limita la diffusione di questa metodologia. Un protocollo che permetta la diretta applicazione sul campo non è stato ancora sperimentato poiché si ha la necessità di rimuovere i CPAs dall’oocita prima del trasferimento.
I risultati ottenuti con differenti procedure confermano che la crioconservazione dell’oocita non è solamente un metodo semplice per aumentare la sopravvivenza e la capacità di sviluppo ma è una metodica maggiormente complessa. Un appropriato equilibrio tra tutti i fattori implicati quali la qualità dell’oocita, i CPAs permeabili e non permeabili, i supporti di crioconservazione, i volumi di vitrificazione, è necessario per minimizzare i danni strutturali e funzionali e per preservare maggiormente le potenziali capacità di sviluppo di oociti vitrificati, fino a stadi preimpianto.
Il modo migliore per aggiungere o rimuovere i crioprotettori dagli oociti e l’ottimizzzazione delle velocità di raffreddamento e di ripristino delle temperature fisiologiche possono essere dedotti da studi teorici fisico chimici. Questo è necessario per implementare la conoscenza sulle procedure di vitrificazione dell’oocita , che spesso deriva da sperimentazione empiriche, con una conoscenza dei processi di criobiologia di base molto scarsa. In questa direzione le piattaforme di trascrittomica, proteomica e metabolomica sono le tecnologie che potranno permettere di delucidare maggiormente questi processi complessi durante le procedure di crioconservazione (Supporto finanziario Regione Sardegna: progetto P5A, Centro di Competenza per la Biodiversità Animale)
Bibliografia
Abe Y, Hara K, Matsumoto H, Kobayashi J, Sasada H, Ekwall H, Rodriguez-Martinez H, Sato E. (2005) “Feasibility of a nylon-mesh holder for vitrification of bovine germinal vesicle oocytes in subsequent production of viable blastocysts” Biol Reprod; 72:1416-1420.
Albarracín JL, Morató R, Izquierdo D, Mogas T. (2005) “Vitrification of calf oocytes: effects of maturation stage and prematuration treatment on the nuclear and cytoskeletal components of oocytes and their subsequent development” Mol Reprod Dev;72:239-249
Aono N, Abe Y, Hara K, Sasada H, Sato E, Yoshida H. (2005) “Production of live offspring from mouse germinal vesicle-stage oocytes vitrified by a modified stepwise method, SWEID Fertil Steril; 84 Suppl 2:1078-82
Bagchi A, Woods EJ, Critser JK. (2008) “Cryopreservation and vitrification: recent advances in fertility preservation technologies” Expert Rev Med Devices; 5:359-370.
Berlinguer F, Succu S, Mossa F, Madeddu M, Bebbere D, Leoni GG, Naitana S. (2007) “Effects of trehalose co-incubation on in vitro matured prepubertal ovine oocyte vitrification” Cryobiology; 55:27-34.
Bielanski A, Vajta G. (2009) “Risk of contamination of germplasm during cryopreservation and cryobanking in IVF units” Hum Reprod; 24:2457-2467.
Bogliolo L, Ariu F, Fois S, Rosati I, Zedda MT, Leoni G, Succu S, Pau S, Ledda S. (2007) “Morphological and biochemical analysis of immature ovine oocytes vitrified with or without cumulus cells” Theriogenology; 68:1138-1149.
Chian RC, Kuwayama M, Tan L, Tan J, Kato O, Nagai T. (2004) “High survival rate of bovine oocytes matured in vitro following vitrification” J Reprod Dev; 50:685-696.
Du Y, Pribenszky CS, Molnár M, Zhang X, Yang H, Kuwayama M, Pedersen AM, Villemoes K, Bolund L, Vajta G. (2008) “High hydrostatic pressure: a new way to improve in vitro developmental competence of porcine matured oocytes after vitrification” Cloning Stem Cells; 10:325-330.
Ducibella T, Schultz RM, Ozil JP. (2006) “Role of calcium signals in early development” Stem Cell Dev Biol; 17:324-332.
Eroglu A, Lawitts JA, Toner M, Toth TL. (2003) “Quantitative microinjection of trehalose into mouse oocytes and zygotes, and its effect on development” Cryobiology; 46:121-134
Eroglu A. (2009) “Cryopreservation of mammalian oocytes by using sugars: Intra- and extracellular raffinose with small amounts of dimethylsulfoxide yields high cryosurvival, fertilization, and development rates” Cryobiology, published online before print.
Fu XW, Shi WQ, Zhang QJ, Zhao XM, Yan CL, Hou YP, Zhou GB, Fan ZQ, Suo L, Wusiman A, Wang YP, Zhu SE. (2009) “Positive effects of Taxol pretreatment on morphology, distribution and ultrastructure of mitochondria and lipid droplets in vitrification of in vitro matured porcine oocytes” Anim Reprod Sci; 115:158-168.
Fuchinoue K, Fukunaga N, Chiba S, Nakajo Y, Yagi A, Kyono K. (2004) “Freezing of human immature oocytes using cryoloops with Taxol in the vitrification solution” J Assist Reprod Genet; 21:307-309.
Fujihira T, Nagai H, Fukui Y. (2005) “Relationship between equilibration times and the presence of cumulus cells, and effect of taxol treatment for vitrification of in vitro matured porcine oocytes” Cryobiology; 51:339-343.
Gardner DK, Sheehan CB, Rienzi L, Katz-Jaffe M, Larman MG. (2007) “Analysis of oocyte physiology to improve cryopreservation procedures” Theriogenology; 67:64-72.
Genicot G, Leroy JL, Soom AV, Donnay I. (2005) “The use of a fluorescent dye, Nile red, to evaluate the lipid content of single mammalian oocytes” Theriogenology; 63:1181-1194.
Hochi S, Kozawa M, Fujimoto T, Hondo E, Yamada J, Oguri N. (1996) “In vitro maturation and transmission electron microscopic observation of horse oocytes after vitrification” Cryobiology; 33:300-310.
Hyttel P, Vajta G, Callesen H. (2000) “Vitrification of bovine oocytes with the open pulled straw method: ultrastructural consequences” Mol Reprod Dev; 56:80-88.
Karlsson JO, Younis AI, Chan AW, Gould KG, Eroglu A. (2009) “Permeability of the rhesus monkey oocyte membrane to water and common cryoprotectants” Mol Reprod Dev; 76:321-333
Kuwayama M. (2007) “Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method” Theriogenology; 67:73-80.
Lane M, Gardner DK. (2006) “Vitrification of mouse oocytes using a nylon loop” Mol Reprod Dev 2001; 58:342–347.
Larman MG, Katz-Jaffe MG, Sheehan CB, Gardner DK. (2007) “1,2-Propanediol and the type of cryopreservation procedure adversly affect mouse oocyte physiology” Hum Reprod; 22:250-259.
Larman MG, Sheehan CB, Gardner DK. (2006) “Calcium-free vitrification reduces cryoprotectant-induced zona pellucida hardening and increases fertilization rates in mouse oocytes” Reproduction; 131:53-61.
Lazzari G, Colleoni S, Lagutina I, Crotti G, Turini P, Tessaro I, Brunetti D, Duchi R, Galli C. (2009) “Short-term and long-term effects of embryo culture in the surrogate sheep oviduct versus in vitro culture for different domestic species” Theriogenology. Aug 31.
Ledda S, Bogliolo L, Succu S, Ariu F, Bebbere D, Leoni GG, Naitana S. (2007) “Oocyte cryopreservation: oocyte assessment and strategies for improving survival” Reprod Fertil Dev; 19:13-23. Review
Leibo SP. (2008) “Cryopreservation of oocytes and embryos: optimization by theoretical versus empirical analysis” Theriogenology; 69:37-47.
Leoni G, Berlinguer F, Rosati I, Bogliolo L, Ledda S, Naitana S. (2003) “Resumption of metabolic activity of vitrified/warmed ovine embryos. Mol Reprod Dev; 64:207-213.
Leoni G, Ledda S, Bogliolo L, Marogna G, Naitana S. (1997) “Heat shock protein 70 in vitrified ovine embryo” Theriogenology; 47:308.
Lin L, Kragh PM, Purup S, Kuwayama M, Du Y, Zhang X, Yang H, Bolund L, Callesen H, Vajta G. (2009) “Osmotic stress induced by sodium chloride, sucrose or trehalose improves cryotolerance and developmental competence of porcine oocytes” Reprod Fertil Dev; 21:338-344
Liu Y, Du Y, Lin L, Li J, Kragh PM, Kuwayama M, Bolund L, Yang H, Vajta G. (2008) “Comparison of efficiency of open pulled straw (OPS) and Cryotop vitrification for cryopreservation of in vitro matured pig oocytes” Cryo Letters; 29:315-320.
Luciano AM, Chigioni S, Lodde V, Franciosi F, Luvoni GC, Modina SC. (2009) “Effect of different cryopreservation protocols on cytoskeleton and gap junction mediated communication integrity in feline germinal vesicle stage oocytes” Cryobiology; 59:90-95.
Mattioli M., B. Barboni, G. Luisa and P. Loi, (2003) “Cold-induced calcium elevation triggers DNA fragmentation in immature pig oocytes” Mol. Reprod. Dev; 65: 289–297.
Maclellan LJ, Carnevale EM, Coutinho da Silva MA, Scoggin CF, Bruemmer JE, Squires EL. (2002) “Pregnancies from vitrified equine oocytes collected from super-stimulated and non-stimulated mares” Theriogenology; 58:911-919.
Marangos P. and Carroll J., (2004) “Fertilization and InsP3-induced Ca2+ release stimulate a persistent increase in the rate of degradation of cyclin B1 specifically in mature mouse oocytes” Dev Biol ; 272: 26–38.
McEvoy TG, Coull GD, Broadbent PJ, Hutchinson JS and Speake BK. (2000) “Fatty acid composition of lipids in immature cattle, pig and sheep oocytes with intact zona pellucida” J. Reprod. Fertil; 118:163–170.
Men H, Agca Y, Riley LK, Critser JK. (2006) “Improved survival of vitrified porcine embryos after partial delipation through chemically stimulated lipolysis and inhibition of apoptosis” Theriogenology; 66:2008-2016.
Men H, Monson RL, Parrish JJ, Rutledge JJ. (2003) “Detection of DNA damage in bovine metaphase II oocytes resulting from cryopreservation” Mol Reprod Dev; 64:245-250.
Merlo B, Iacono E, Regazzini M, Zambelli D. (2008) “Cat blastocysts produced in vitro from oocytes vitrified using the cryoloop technique and cryopreserved electroejaculated semen” Theriogenology; 70:126-130.
Morató R, Izquierdo D, Paramio MT, Mogas T. (2008) “Cryotops versus open-pulled straws (OPS) as carriers for the cryopreservation of bovine oocytes: effects on spindle and chromosome configuration and embryo development” Cryobiology; 57:137-141.
Morató R, Mogas T, Maddox-Hyttel P. (2008) “Ultrastructure of bovine oocytes exposed to Taxol prior to OPS vitrification” Mol Reprod Dev; 75:1318-1326.
Nakagawa S, Yoneda A, Hayakawa K, Watanabe T. (2008) “Improvement in the in vitro maturation rate of porcine oocytes vitrified at the germinal vesicle stage by treatment with a mitochondrial permeability transition inhibitor” Cryobiology; 57:269-275.
Ozil JP, Banrezes B, Tóth S, Pan H, Schultz RM. (2006) “Ca2+ oscillatory pattern in fertilized mouse eggs affects gene expression and development to term” Dev Biol; 15:534-544.
Park SE, Chung HM, Cha KY, Hwang WS, Lee ES, Lim JM. (2001) “Cryopreservation of ICR mouse oocytes: improved post-thawed preimplantation development after vitrification using Taxol, a cytoskeleton stabilizer” Fertil Steril; 75:1177-1784.
Parmegiani L, Accorsi A, Cognigni GE, Bernardi S, Troilo E, Filicori M. (2009) “Sterilization of liquid nitrogen with ultraviolet irradiation for safe vitrification of human oocytes or embryos” Fertil Steril. Jul 8.
Pereira RM, Marques CC. (2008) “Animal oocyte and embryo cryopreservation” Cell Tissue Bank; 9:267-277.
Rho GJ, Kim S, Yoo JG, Balasubramanian S, Lee HJ, Choe SY. (2002) “Microtubulin configuration and mitochondrial distribution after ultra-rapid cooling of bovine oocytes” Mol Reprod Dev; 63:464-470.
Rojas C, Palomo MJ, Albarracín JL, Mogas T. (2004) “Vitrification of immature and in vitro matured pig oocytes: study of distribution of chromosomes, microtubules, and actin microfilaments” Cryobiology; 49:211-220.
Seki S, Mazur P. (2008 ) “Effect of warming rate on the survival of vitrified mouse oocytes and on the recrystallization of intracellular ice” Biol Reprod; 79:727-37.
Silvestre MA, Yániz J, Salvador I, Santolaria P, López-Gatius F. (2006) “Vitrification of pre-pubertal ovine cumulus-oocyte complexes: effect of cytochalasin B pre-treatment” Anim Reprod Sci; 93:176-182.
Somfai T, Kashiwazaki N, Ozawa M, Nakai M, Maedomari N, Noguchi J, Kaneko H, Nagai T, Kikuchi K. (2008) “Effect of centrifugation treatment before vitrification on the viability of porcine mature oocytes and zygotes produced in vitro” J Reprod Dev; 54:149-155.
Somfai T, Ozawa M, Noguchi J, Kaneko H, Kuriani Karja NW, Farhudin M, Dinnyés A, Nagai T, Kikuchi K. (2007) “Developmental competence of in vitro-fertilized porcine oocytes after in vitro maturation and solid surface vitrification: effect of cryopreservation on oocyte antioxidative system and cell cycle stage” Cryobiology; 55:115-126.
Stachowiak EM, Papis K, Kruszewski M, Iwaneńko T, Bartłomiejczyk T, Modliński JA (2009) “Comparison of the level(s) of DNA damage using Comet assay in bovine oocytes subjected to selected vitrification methods” Reprod Domest Anim.; 44:653-658.
Succu S, Bebbere D, Bogliolo L, Ariu F, Fois S, Leoni GG, Berlinguer F, Naitana S, Ledda S. (2008) “Vitrification of in vitro matured ovine oocytes affects in vitro pre-implantation development and mRNA abundance” Mol Reprod Dev; 75:538-546.
Succu S, Leoni GG, Bebbere D, Berlinguer F, Mossa F, Bogliolo L, Madeddu M, Ledda S, Naitana S. (2007) “Vitrification devices affect structural and molecular status of in vitro matured ovine oocytes” Mol Reprod Dev; 74:1337-1344
Succu S, Leoni GG, Berlinguer F, Madeddu M, Bebbere D, Mossa F, Bogliolo L, Ledda S, Naitana S. (2007) “Effect of vitrification solutions and cooling upon in vitro matured prepubertal ovine oocytes” Theriogenology; 68:107-114.
Tharasanit T, Colleoni S, Galli C, Colenbrander B, Stout TA (2009) “Protective effects of the cumulus-corona radiata complex during vitrification of horse oocytes” Reproduction; 137:391-401.
Tian SJ, Yan CL, Yang HX, Zhou GB, Yang ZQ, Zhu SE. (2007) “Vitrification solution containing DMSO and EG can induce parthenogenetic activation of in vitro matured ovine oocytes and decrease sperm penetration” Anim Reprod Sci; 101:365-371.
Vajta G, Kuwayama M. (2006) “Improving cryopreservation systems” Theriogenology; 65:236-244.
Vajta G, Nagy ZP. (2006) “Are programmable freezers still needed in the embryo laboratory? Review on vitrification” Reprod Biomed Online; 12:779-796.
Van der Abbeel E, Schneider U, Liu J, Agca Y, Critser JK, Van Steirteghem A. (2007) “Osmotic responses and tolerance limits to changes in external osmolalities, and oolemma permeability characteristics, of human in vitro matured MII oocytes” Hum Reprod; 22:1959-(1972.
Van der Elst J, Amerijckx Y, Van Steirteghem A. 1998) “Ultra-rapid freezing of mouse oocytes lowers the cell number in the inner cell mass of 5 day old in-vitro cultured blastocysts” Hum Reprod; 13:1595-1599
Vieira AD, Mezzalira A, Barbieri DP, Lehmkuhl RC, Rubin MI, Vajta G. (2004) “Calves born after open pulled straw vitrification of immature bovine oocytes” Cryobiology. 2002; 45:91-94.
Yan CL, Fu XW, Zhou GB, Zhao XM, Suo L, Zhu SE. (2009) “Mitochondrial behaviors in the vitrified mouse oocyte and its parthenogenetic embryo: effect of Taxol pretreatment and relationship to competence” Fertil Steril. Feb 23
Yavin S, Arav A. (2007) “Measurement of essential physical properties of vitrification solutions” Theriogenology; 67:81-89.
Zeron Y, Sklan D, Arav A. (2002) “Effect of polyunsaturated fatty acid supplementation on biophysical parameters and chilling sensitivity of ewe oocytes” Mol Reprod Dev; 61:271-278
Zeron Y, Tomczak M, Crowe J, Arav A. (2002) “The effect of liposomes on thermotropic membrane phase transitions of bovine spermatozoa and oocytes: implications for reducing chilling sensitivity” Cryobiology; 45:143-152.
Zhang J, Nedambale TL, Yang M, Li J. (2009) “Improved development of ovine matured oocyte following solid surface vitrification (SSV): effect of cumulus cells and cytoskeleton stabilizer” Anim Reprod Sci; 110:46-55.
____________________
Dipartimento di Biologia Animale1, Dipartimento di Scienze Fisiologiche Biochimiche e Cellulari2, Dipartimento di Patologia e Clinica veterinaria3, Centro di Competenza per la Biodiversità Animale, Università degli Studi di Sassari.

